Р.М. Гаррелс, Ч.Л.Крайст "Розчини, мінерали, рівноваги"
- СТІЙКІСТЬ ВОДИ
- СТІЙКІСТЬ ОКИСЛІВ ЖЕЛЕЗА
- ДІАГРАМА Р O2 - Р CO2, СИСТЕМА Fe - O2 - СО2
- СИСТЕМА Сu - CO2 - О2
- Діаграми Р O2 - P S2 СИСТЕМА Fе - O2 - S2
- СИСТЕМА Сu - S2 - O2
- Діаграми Р O2 - Р CO2 - P S2 СИСТЕМА Fe - O2 - CO2 - S2
- СИСТЕМА Сu - О2 - СО2 - S2
- НАКЛАДАННЯ ДІАГРАМ
- СИСТЕМА Fe - Мn - O2 - S2
- СИСТЕМА Fe - Mn - O2 - CO2
- СИСТЕМА Fe - Сu - О2 - S2
- ВИСНОВОК
- вправо
- Л І Т Е Р А Т У Р А
- РЕКОМЕНДОВАНА ЛІТЕРАТУРА
Рівноважні співвідношення між мінералами при 25 ° С і 1 атм загального тиску обумовлюються реакціями першого типу, т. Е. Реакціями за участю лише твердих речовин. Графічно зобразити ці співвідношення неможливо, так як вони залежать тільки від температури і тиску. Лише в рідкісних випадках вільна енергія такої реакції при подібних довільно обраних умовах дорівнює нулю. Однак реакцію другого типу - за участю газової фази будь-якої активності - можна уявити графічно у вигляді функції активності даної газової фази. В умовах цікавлять нас низьких температур і тисків активність газової фази безпосередньо визначається величиною її парціального тиску. Практично це справедливо для всіх газів, бо вони в таких умовах близькі до ідеального. Співвідношення між фугітівності, активністю і тиском детально були розглянуті в гл. 2.
СТІЙКІСТЬ ВОДИ
З усіх хімічних співвідношень найбільший інтерес для геологів представляє стійкість води. Припускаючи існування рівноваги між водою і продуктами її дисоціації - воднем і киснем, можна написати
2H2Oжідк = 2H2 газ + O2 газ. (6.1)
Константа рівноваги цієї реакції дорівнює
але для майже чистої води [Н2О] @ 1, і тому
Співвідношення вільних енергій для рівняння (6.1) буде наступним:
2 DF ° обр H2 + DF ° обр O2 - 2 DF ° обр H2O = DF ° реакції. (6.4)
Підставивши чисельні значення цих величин, отримаємо
0 + 0 + 113,4 = DF ° реакції. (6.5)
Тепер, виходячи із залежності між стандартною вільної енергією реакції і константою рівноваги, по якій DF ° реакції = 4.364 lg K, визначаємо
113,4 = -1,364 lg K,
K = 10-83,1.
З рівняння (5.3) знаходимо
Таким чином, ступінь дисоціації води на водень і кисень при кімнатній температурі мізерно мала. Проте, допускаючи наявність рівноваги, для характеристики меж стійкості води можна використовувати парціальні тиску кисню і водню. якщо парціальний
тиск одного з газів (водню або кисню) в умовах земної поверхні перевищить 1 атм, т. е. буде більшим, ніж атмосферний тиск, то з води почне виділятися інший газ (кисень або водень відповідно), таким чином, вода буде розкладатися і поставляти (в атмосферу) додаткові кількості кисню і водню. Якщо Р O2 = 1, то
P
2H2 = 10-83,1, P H2 = 10-41,5. (6.7)
Коли Р H2 = 1, то
Якими б не були окремо задані парціальні тиску водню або кисню, рівноважний їхнє ставлення (з водою) буде цілком визначеним. Для подальшого викладу доцільно побудувати графік залежності Р O2 від Р H2 прн рівновазі з водою: якщо відомо тиск одного з цих газів, то тиск іншого можна визначити, не вдаючись до спеціальних обчислень (фіг. 6.1).
СТІЙКІСТЬ ОКИСЛІВ ЖЕЛЕЗА
Таким же чином можна розрахувати стану стійкості серед оксидів заліза, які представляють певний мінералогічний інтерес. Перш за все треба скласти реакції їх утворення з сполук заліза і газоподібного кисню, причому бажано врахувати всі перестановки і комбінації:
Оскільки активність кристалічних речовин дорівнює одиниці, кожна реакція буде перебувати в рівновазі при конкретному парціальному тиску кисню. Необхідні обчислення ілюструються розрахунком Р O2 для рівноважного стану в реакції (6.14):
Стандартна вільна енергія цієї реакції така:
Після підстановки чисельних значень отримаємо:
Звідси
У табл. 6.1 наводяться результати аналогічних обчислень за всіма згаданими вище реакцій.
Рівноважні співвідношення між цими сполуками виявляються ще краще, якщо нанести відповідні значення на лінійний графік тисків (фіг. 6.2). Тепер, починаючи з нижньої частини графіка, можна простежити за результатами, які мали б місце при впливі на металеве залізо кисню зі зростаючим парціальним тиском. (При цьому передбачається настільки повільне підвищення тиску, що зберігається приблизна рівновага.) Однак подібний експеримент провести не можна
Таблиця 6.1
Парціальні тиску кисню для рівноважного стану з'єднань кисню і заліза при 25 ° С і 1 атм загального тискуРеакціяP O2 lgP O2 Feкріст + 1 / 2O2 газ = FeОкріст 10-85,6 -85,6 3Feкріст + 2O2 газ = Fe3O4 крист
2Feкріст + 3 / 2O2 газ = Fe2O3 крист 10-88,9
10-86,6 -88,9
-86,6 3FeOкpіcт + 1 / 2O2 газ = Fe3O4 крист 10-98,5 -98,5 2FеОкріст + 1 / 2О2 газ = Fe2О3 крист 10-88,4 -88,4 2Fe3O4 крист + 1 / 2O2 газ = 3Fe2O3 крист 10-68,2 -68,2
через занадто низьких тисків кисню. Попередньо обчислені значення тиску, хоча і не можуть бути реалізовані при дійсному окисленні, все ж дають вельми корисні орієнтовні дані.
Перша реакція, з якою ми зустрічаємося на графіку, - реакція перетворення FeO в Fе3O4 - безумовно метастабильна, так як FeO взагалі не може окислюватися в Fе3O4, поки не окислиться всі залізо. Таким чином, залізо буде стійким до тих пір, поки P O2 не досягне значення 10-89, при якому Feкріст і Fе3O4 крист знаходяться в рівновазі. При значенні Р О2 = 10-88 залізо буде переходити в Fе3O4. Наступна реакція (окислення заліза до Fе2O3) також метастабильна, бо залізо окислюється до магнетиту раніше, ніж до FeO. Іншими словами,
Таким чином, ми висловлюємо це співвідношення у вигляді реакції між твердими речовинами і знаходимо, що DF ° реакції негативна, а FeO при кімнатній температурі буде необоротно переходити (діспропорціоніровать) в мaгнетіт і металеве залізо. У зв'язку з цим FeO не володіє полем стійкості. Взагалі існує багато способів перевірки метастабільних співвідношень, але найвірнішим критерієм може служити Р O2.
Діючи далі вгору по лінійному графіку Р O2, ми зустрічаємося з останньої реакцією - окисленням Fe3O4 в Fe2О3.
Тепер ми можемо побудувати спрощений лінійний графік з урахуванням тільки стабільних фаз Fe, Fe3O4 і Fe2O3, і на нашу долю випадає перший успіх, пов'язаний з використанням Р O2, - ми отримуємо можливість безпосередньо порівняти рівноважне значення Р O2 для оксидів заліза і для води (фіг . 6.3). Хоча, мабуть, значення Р O2, рівне 10-89, саме по собі майже не має фізичного сенсу, але при порівнянні його з межами стійкості води можна переконатися в тому, що в умовах земної поверхні металеве залізо в присутності води хитке і що , крім того, магнетит окислюється до гематиту поблизу нижньої межі стійкості води. У зв'язку з цим гематит, хоча і є з'єднанням окисно-го заліза з киснем, все ж, очевидно, служить поганим індикатором середовища, будучи стійким в досить широких межах окислювальних умов. Разом з тим магнетит можна було б прийняти за окислене з'єднання, так
як дві третини його заліза тривалентного. Однак магнетит стійкий тільки в сильно відновної середовищі і не відновлюється мимовільному в присутності води і водню при тиску 1 атм.
Фіг. 6.3 характеризує такі взаємини між залізом, воднем і киснем, які можна уявити також у вигляді трикомпонентної діаграми складу Fe - O2 - Н2. Прикладом подібної діаграми служить фіг. 6.4, з'єднувальні лінії якої проведені за даними, знятим з графіка фіг. 6.3. У нижній частині фіг. 6.3 співіснують залізо і водень, а вода нестійка. Таким чином, на фіг. 6.4 цього полю відповідає сполучна Лінія між залізом і воднем. Це поле на фіг. 6.3 не залежить від кількості присутнього заліза (важливий лише сам факт наявності елементарного Fe), що і відображено в широкому діапазоні складів, позначеному згаданої сполучної лінією на фіг. 6.4. Трьохфазову поле Fe - Н2 - Fe3O4 точно так же на фіг. 6.3 відбивається лінією, яка б показала, що при спільному існуванні цих трьох фаз тиску кисню і, водню інваріантні. Зауважимо, що при зіставленні фіг. 6.3 і 6.4 зручно визначати приватні значення тиску газів в трьохфазову полях і межі тисків, допустимих для двофазових асоціацій.
ДІАГРАМА Р O2 - Р CO2,
СИСТЕМА Fe - O2 - СО2
Простота графічного зображення взаємин між сполуками заліза і кисню, коли можна використовувати навіть лінійні графіки, природно передбачає можливість, графічного зображення реакцій з парціальними тисками двох газів в якості змінних. Для мінералів заліза найцікавіше використовувати такі гази, як CO2 і S2. Почнемо з CO2 і напишемо реакції переходу від металевого заліза і його оксидів до одного і того ж карбонатного мінералу - сидериту:
Для реакції (6.20) маємо
Звідси
і
Подібні розрахунки для реакцій (6.21) і (6.22) дають наступні співвідношення:
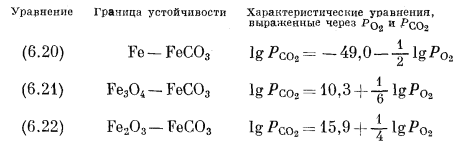
На графіку, осями координат якого служать lg P O2 і lg P CO2, кордони між сполуками в кожній з трьох пар є прямі лінії з нахилом відповідно в - 1/2, + 1/6 і + l / 4. Ці кордони і показані на фіг. 6.5 разом з межами стійкості оксидів заліза і води. Нанести ці прямі на графік дуже просто. Треба поставити собі довільним значенням Р CO2, визначити відповідну величину Р O2 і потім провести через отриману точку лінію з належним нахилом.
Розглядаючи фіг. 6.5, можна встановити метастабільній деяких співвідношень на окремих ділянках діаграми. Наприклад, межа між Fe і FeCO3 при тиску кисню вище 10-88 чітко метастабильна, оскільки при більшому тиску залізо нестійкий по відношенню до окислам. Виключивши метастабільні співвідношення, отримуємо остаточну діаграму, наведену на фіг. 6.6. Тут вже можна позначити поля стійкості. При порівнянні фіг. 6.5 і 6.6 видно, що використовуються значення вільної енергії щонайменше можна порівняти між собою. Зверніть увагу, як на фіг. 6.5 перетинаються лінії рівнянь (6.14), (6.21) і (6.22), а також рівнянь (6.21), (6.20) і (6.10). Трикутники розбіжності в зазначених місцях перетину свідчать про те, що у визначенні значень вільної енергії для одного з рівнянь допущена помилка. На фіг. 6.6 межа між Fe2O3 і FeCO3 при значеннях Р CO2 вище 10 ° позначена штриховою лінією, що вказує на верхню межу застосовності розрахунків по парціальним тискам з використанням даних, справедливих лише при 25 ° і 1 аmм загального тиску. При обчисленнях кордонів стійкості фаз активності твердих речовин для будь-якого загального тиску, приймаються рівними одиниці. Такий прийом не суперечить результатам, розглянутим в гол. 9, де показано, що відносні активності твердих речовин в будь-якій даній реакції істотно не відхиляються від одиниці при збільшенні загального тиску від 1 атм до тиску порядку 50 аmм. Крім того, зроблено припущення про рівність Р газ = a газ при всіх значеннях P газ. Діаграма подібного типу дійсна тільки для розгляду співвідношень між врахованими компонентами: з її допомогою можна встановити, чи є в системі такі компоненти, які не враховано, але по відношенню до яких будуть нестійкі розглядаються компоненти. це,
зокрема, виявляється при накладенні діаграми Fe - O2 - СО2 на діаграму H2O - H2; не виключено, що Fe2O3 і Н2О можуть бути нестійкі в зв'язку з реакцією Fe2О3 крист + Н2Ожідк = 2FеООНкріст. А раз так, то поле гематит - вода заместилось б полем гетит - вода, причому останнє могло б виявитися більше показаного поля гематит - вода. При простому накладення діаграм стійкості, побудованих в однакових координатах, завжди слід з'ясувати, чи не буде взаємодія між зіставляється компонентами призводити до утворення якихось інших, нових компонентів. Важко переоцінити той факт, що за допомогою розглянутих вище методів можна побудувати цілком задовільні діаграми співвідношень стійкості досліджуваних компонентів, але все ж у нас немає гарантії, що враховані співвідношення вичерпують все співвідношення, які слід було б взяти до уваги. Як правило, більш надійну відповідь швидше можна отримати на питання, які компоненти не можуть перебувати в рівновазі (наприклад, Fe і H2O), ніж на питання, які можуть (наприклад, Fе2О3 і H2O). Таким чином, найвірніший робочий метод полягає в перевірці равновесности фактичних мінеральних асоціацій.
СИСТЕМА Сu - CO2 - О2
Можна було б побудувати велику кількість діаграм подібного типу, якби наші інтереси не обмежувалися тільки киснево-карбонатними співвідношеннями для окремих елементів періодичної системи (і якби були всі дані по вільним енергій). У зв'язку з цим особливо великий інтерес для геолога представляють мінерали міді, що обумовлено економічною значимістю процесів окислення і вторинного збагачення. До того ж на них зручно демонструвати результати взаємодії з водою. Головними сполуками в нашій системі будуть самородна мідь Сu, куприт Сu2O, тенор СuО, малахіт Сu2 (ОH) 2СО3 і азурит Сu3 (ОН) 2 (СО3) 2. Якщо обмежитися значеннями Р O2, що лежать в полі стійкості води (Р O2 = 10-83,1 - 100), то ми отримаємо можливість досліджувати взаємодію між різними сполуками міді за допомогою рівнянь ,, що враховують майже чисту рідку воду. Природні розчини, циркулюючі в зоні окислення мідних родовищ, зазвичай розбавлені, в зв'язку з чим їх активність може бути прирівняна до активності чистої води.
Нижче наведені реакції взаємодії в нашій системі (тут виключені метастабільні реакції, як це було зроблено і для сполук заліза):
Цим реакціям відповідають наступні рівняння:
Рівняння Кордон стійкості Характеристичні рівняння,
виражені через Р O2 і Р CO2 (6.23) Сu - Cu2O lg Р O2 = -51,30 (6.24) Cu2O - СuО lg Р O2 = -37,6 (6.25) Сu - Сu3 (ОН) 2 (СО3) 2 lg Р CO2 = -36,9 - 3/4 lg Р O2 (6.26) Сu2О - Сu3 (ОН) 2 (СО3) 2 lg Р CO2 = -17,6 - 3/8 lg Р O2 (6.27) Cu2O - Сu2 ( ОН) 2СО3 lg Р CO2 = -22,7- 1/2 lg Р O2 (6.28) СuО -Сu2 (ОН) 2СО3 lg Р CO2 = -3,8 (6.29) Сu2 (ОН) 2СО3 - Сu3 (ОН) 2 (СО3) 2 lg Р CO2 = -2,5
Результати графічного зображення отриманих рівнянь наведені на фіг. 6.7. Загальні закономірності дивним чином схожі з тими, які були виявлені для оксидів і карбонату заліза і представлені на фіг. 6.6. Невелика відмінність полягає в появі ще одного карбонатного з'єднання. Нова діаграма підводить нас до деяких цікавих висновків. У поверхневих умовах при високому значенні Р O2 і при Р CO2, що дорівнює 10-3,5, малахіт стійкий щодо азуриту. Азурит може стати стійким тільки при підвищенні Р CO2 або при зменшенні активності води [рівняння (6.29)] 1 (стор.142) . Таким чином, в сухому полуарідние кліматі відносна вологість повітря настільки мала, що виявляється цілком можливим стійке існування азуриту. Але якщо зразки азуриту потрапляють в умови більш високої вологості, то він починає переходити в малахіт. Цим і пояснюється зелений колір неба на багатьох картинах, вивезених з країн, де азурит служить стійким барвником.
Діаграми Р O2 - P S2
СИСТЕМА Fе - O2 - S2
За допомогою діаграм парціальних тисків також зручно розглянути взаємини між сульфідами і оксидами металів. Для характеристики подібних співвідношень ми використовуємо двоатомний газоподібну сірку. Молекулярні частки газоподібної сірки при 25 ° С навряд чи стійкі; ймовірніше, що в таких умовах сірка знаходиться в вигляді частинок з великим числом атомів, ніж S2. Однак для наших цілей вибір газових частинок не має істотного значення, оскільки вони використовуються тільки в якості критерію, що дозволяє порівнювати реакції мінералів заліза з реакціями між іншими мінералами. Крім того, визначивши стійкі співвідношення, виражені у вигляді функції будь-якої зручної пари змінних величин, на зразок Р O2 і P S2, ми можемо при бажанні перерахувати отримані відносини, висловивши їх у вигляді функції інших газів. Для цього достатньо скласти реакції взаємодії між спочатку прийнятими і новими змінними.
Як завжди, перш за все напишемо реакції між мінералами і газами. Методика тепер уже ясна. Спочатку ми пишемо рівняння для реакцій, що включають тільки по одній змінній:
За нею йдуть реакції за участю обох змінних:
1 (стор.142)
Азурит в природі дуже часто переходить в малахіт, який утворює псевдоморфози по азуриту. Зворотний перехід без утворення розчинних комплексних карбонатних з'єднань неізвестен.- Прим. ред.,
Зверніть увагу, що тут ми змогли врахувати попередній досвід дослідження співвідношень між оксидами заліза (фіг. 6.2) і з подальшого аналізу співвідношень між залізом і киснем виключили всі реакції, крім стабільних. При складанні рівнянь реакцій в системах залізо - сірка і залізо - кисень - сірка для початку слід врахувати всі реакції, які нам підказують мінералогічні спостереження. Тут відсутній тільки одна з них - реакція між Fe2O3 і S2 з утворенням FeS.
Якщо її розрахувати і нанести на діаграму, то можна виявити, що вона метастабильна (втім, про це можна здогадатися і на підставі мінералогічних співвідношень). Крім того, ми обмежили наші інтереси тільки сульфідами, хоча в результаті взаємодії заліза, сірки і кисню можуть утворюватися також сульфати і деякі сполуки сірки з киснем. Однак ми свідомо обмежуємо своє. увагу сульфідами і не збираємося досліджувати все взаємодії, можливі в системі залізо - кисень - сірка.
І ще одне Останнє застереження, Пожалуйста ми годину від годині будемо повторюваті. Наші обчислення зроблені для з'єднання FеSкріст, Істинний склад которого відповідає Формулі Fe1- x S, а не FeS. Тому прийнятя величина Вільної ЕНЕРГІЇ відносіться до приватного складу Fе0,95S, як це дано в табліці вільніх енергій в додатку 2, і не може вважатися справедливою для будь-якого складу. Хоча зазвичай помилка, пов'язана з відхиленням цих величин від строгих стехиометрических відносин, невелика, її необхідно прийняти до уваги і оцінити, приступаючи до дійсно серйозним розрахунками.
На Фіг. 6.8 зведені результати визначення констант рівноваги для рівнянь (6.10), (6.14) і (6.30) - (6.34). Навіть незважаючи на те, що ця діаграма складена для 25 ° С, вона вказує на самі звичайні для геолога можливі і заборонені асоціації. Наприклад, можлива потрійна асоціація пирротин - пірит - магнетит, і неможливо спільне виділення пирротина і гематиту. Положення кордону стійкості води також говорить багато про що. Рівноваги, зображені на діаграмі, що не залежать від води, а сама вода не є необхідним супутником розглянутих мінералів заліза. Однак слід зазначити, що пирротин і вода можуть співіснувати при 25 ° С тільки в дуже обмежених умовах.
СИСТЕМА Сu - S2 - O2
Аналіз системи з міддю аналогічний тільки що розібраному нагоди. У ній беруть участь такі реакції:
У наведених реакціях не бере одне цікавить нас з'єднання, а саме мінерал дігеніт Cu9S5. У довідковій літературі дані по вільної енергії дігеніта відсутні. Тому ми не враховуємо це з'єднання, але зауважуємо, що були б раді врахувати і його. Відносно Cu2S слід зробити те ж застереження, що і відносно FeS, бо склад халькозіна зазвичай не відповідає стехиометрической формулою.
Графічні побудови фіг. 6.9 засновані на константах рівноваги, обчислених за рівнянням (6.23), (6.24) і (6.35) - (6.39). Ця діаграма дуже схожа на відповідну діаграму для системи Fe - S2 - О2.
Діаграми Р O2 - Р CO2 - P S2
СИСТЕМА Fe - O2 - CO2 - S2
Стійкі співвідношення між сполуками заліза можуть бути виражені як у вигляді функції Р O2 і P S2, так і у вигляді функції P O2 і P CO2. Це природно наводить на думку про можливість зображення тих же співвідношень у вигляді функції відразу всіх трьох змінних. Результат об'єднання діаграм фіг. 6.8 і 6.6 наведено на фіг. 6.10. Побудова нової діаграми
досить просто і полягає в наступному. Будуємо осі координат P S2 і Р CO2 під прямим кутом до загальної осі Р O2 і потім знаходимо лінії перетину площин. Для цієї системи необхідно скласти ще одне нове рівняння, що виражає співвідношення піриту і сідеріта:
Це рівняння визначає єдину кордон (площину розділу), яка не складає прямого кута з жодною з осей координат, так як в цій реакції беруть участь всі три змінні.
СИСТЕМА Сu - О2 - СО2 - S2
Співвідношення між деякими окисними сполуками міді, гідро-оксікарбонатамі і сульфідами також можна виразити у вигляді функції трьох парціальних тисків; відповідна діаграма приведена на фіг. 6.11.
Ця діаграма відображає і співвідношення сполук міді при тисках CO2, набагато перевищують ті межі, для яких ці дані можуть бути використані. Все таки наведена діаграма дає чітке уявлення про те, яке високе тиск CO2 потрібно створити, щоб перетворити сульфіди в гідрокарбонати при низькому парціальному тиску кисню. В іншому в межах нормальних значень парціальних тисків ця діаграма цілком задовільна.
НАКЛАДАННЯ ДІАГРАМ
Так як діаграми парціальних тисків для мінералів з різними мінералообразующего елементами можна виразити через одні й ті ж змінні, часто видається цікавим накласти такі діаграми один на одного і порівняти становище полів стійкості сульфідів, оксидів і карбонатів різних металів.
СИСТЕМА Fe - Мn - O2 - S2
На Фіг. 6.12 суміщені діаграма Р O2 - P S2 Для марганцю з раніше побудованої такий же діаграмою для заліза (фіг. 6.8). Але це не просте накладення двох діаграм один на одного, так як в систему вноситься нове
обмеження. Парціальний тиск S2 в рівноважному стані з алабандин MnS при низьких значеннях Р CO2 має перевищувати 1 атм. Це змушує нас згадати, що тиск пари твердої сірки при низьких температуpax, ймовірно, досить мало і його варто визначити, якщо розглядати у вигляді можливої фази тверду сірку. Отже,
S2 газ = 2Sромбіч, (6.41) 2 DF ° обрSкріст - 2 DF ° обрS2 газ = DF ° реакції, 0 - 19,13 = -19,13, -19,13 = - 1,364 lg К, lg K = 14 = lg 1 / P S2, lg P S2 = - 14.
Таким чином, тиск пара S2 в умовах рівноваги з самородної сірої одно 10-14 і не може перевищити цю величину, бо активність S2 визначається наявністю її в твердій фазі. Отже, не треба турбуватися про всіх тих компонентах, які стійкі при значеннях P S2, що перевищують 10-14, і при такому тиску до досліджуваних асоціаціям можна додати сірку. Цим підкреслюється як придатність подібних діаграм для з'ясування можливих і заборонених асоціацій, так і небезпека їх використання в якості прогнозних схем, так як інша, здавалося б, допустима асоціація може виявитися метастабільною щодо неврахованих компонентів. Ось деякі важливі особливості, встановлені за допомогою цієї діаграми: 1) вкрай обмежене поле співіснування алабандин і води узгоджується з рідкісною поширеністю алабандин в природі; 2) можливість співіснування Fе2О3 і МnО в обмежених межах зміни тиску кисню; 3) можливість спільного перебування Мn3O4 і FeS2; 4) широке поле стійкості Fе2О3, яке перекриває ряд полів окислів марганцю. Крім іншого, Мn3О4 і Fе3O4, мабуть, являють собою неможливу асоціацію, хоча встановлена різниця в тиску кисню між межами стійкості цих сполук настільки мала, що висловлене висновок видається сумнівним 1 (стор.148) .
СИСТЕМА Fe - Mn - O2 - CO2
Співвідношення між оксидами і карбонатами заліза і марганцю показані на фіг. 6.13. Вона ілюструє значно більшу стійкість чистого карбонату марганцю по відношенню до окислам марганцю, ніж карбонату заліза по відношенню до окислам заліза. Зіставлення особливостей поведінки заліза і марганцю, з одного боку, служить нам нагадуванням про можливе їх взаємодії з утворенням, наприклад, з'єднання типу (Fе x Мn y) СО3, а з іншого, - про те, що ми розглядаємо все ж дві окремі діаграми, без урахування взаємодії між зіставляється компонентами. Взагалі кажучи, в прийнятих нами умовах утворення твердого розчину малоймовірно.
СИСТЕМА Fe - Сu - О2 - S2
Накладення діаграми Fe - О2 - S2 (фіг. 6.8) на діаграму Сu - О2 - S2 (фіг. 6.9) показано на фіг. 6.14. У цій суміщеної діаграмі абсолютно не враховуються сполуки, що містять одночасно мідь і залізо, подібні халькопирита CuFeS2 або борніту Cu5FeS4. Натарайан [3] спробував розглянути подібні взаємини, грунтуючись на
1 (стор.148)
Вищі оксиди Mn здатні окисляти FeO, який є компонентом Fe3O4, до Fe2O3.- Прим. ред.
діаграмах Мак-Кінстрі і Кеннеді [1, 2]; в цих роботах зібрані дані по природним асоціаціям мінералів, можливим в розглядуваної нами системі. Щоб підійти до з'ясування стійких співвідношень компонентів при 25 ° С, Натарайан вивчив мінералогію зони окислення і вторинного сульфідного збагачення. Діаграма складу для системи Сu - Fe - S2 при 25 ° С в тому вигляді, як вона була складена Натарайаном, показана на фіг. 6.15. Аналізуючи діаграму в напрямку, зазначеному довгою стрілкою (в сторону підвищення вмісту сірки), ми зустрінемо ряд реакцій, для яких
можуть бути складені відповідні рівняння; останні ми позначимо буквами, проставленими на діаграмі складу близько відповідних сполучних ліній.
Рухаючись від лінії, що з'єднує Сu і Fe, ми потрапляємо в трьохфазову поле Сu - Fe - FeS і потім досягаємо лінії Сu - FeS (асоціація Сu - FeS в природі не відома; це, ймовірно, обумовлено необхідністю низького тиску S2 при тиску О2 нижче того межі, який характеризує рівновагу з водою). Зазначене трьохфазову поле існує при постійному P S2 і відповідає вертикальній лінії на діаграмі Р O2 - P S2. Ця лінія визначається реакцією
Наступною буде реакція переходу від асоціації Сu4-FeS до асоціації Cu2S + FeS
і далі в тій же послідовності:
У нас немає даних по вільної енергії освіти Cu5FeS4, а для CuFeS2 вони тільки приблизні. Однак ми можемо отримати досить точні значення констант для всіх перерахованих вище реакцій. А яким чином - це найкраще пояснить аналіз фіг. 6.16, на якій зображені стійкі співвідношення, виведені для всіх з'єднань. Основою для побудови цієї діаграми послужила фіг. 6.14, де були показані поля стійкості з'єднань з відомими значеннями вільних енергій. Отже, реакції (А) - (Н) дають послідовність, в якій будуть утворюватися мінерали при збільшенні P S2; завдяки цьому ми можемо визначити справжній стан тонких ліній в нижній частині діаграми, орієнтуючись по відомим кордонів стійкості. Потім, використовуючи додаткові відомості щодо можливих асоціаціям, почерпнуті шляхом аналізу четверний системи Сu - Fe - O2 - S2, необхідно уточнити положення кожної тонкої лінії, що відображає нові рівноваги. Визначити кордон стійкості звичайних асоціацій CuFeS2 - Fе3O4 і CuFeS2 - Fe2O3 ми в змозі, так як граничну лінію для реакції Cu5FeS4 + 5FeS + S2 = 5CuFeS2 + FeS (D) можна провести на діаграмі з точністю до 1-2 логарифмічних одиниць P S2. Крім того, оскільки нахил ліній, що відображають всі рівноваги, відомий незалежно від абсолютних їх значень, а місце кордону приблизно визначено по P S2 для реакції (D), то можна встановити і положення кордони для реакції 5СuFеS2 + FeS2 + S2 = Cu5FeS4 + 5FeS2. Тут слід вказати, що будь-яка суттєва зміна положення цих двох кордонів призведе до "зникнення" (на діаграмі) будь-якої відомої природної асоціації або ж, навпаки, "виявить" наявність асоціації, в дійсності невідомою.
Фіг. 6.16 не претендує на високу точність зображення стійких співвідношень для даної системи, але служить цінної робочої схемою, за допомогою якої можна досліджувати природні співвідношення мінералів або аналізувати дані експериментів.
[На фіг. 6.17 показані співвідношення в системі РbО2 - CO2 - S2, що включає галенит PbS, церуссит PbCO3, англезит PbSO4, Платтнером РbО2 і інші мінерали свінца.- Ред.]
ВИСНОВОК
У цьому розділі ми розібрали ряд діаграм, продемонструвавши тим самим, наскільки доцільно виражати співвідношення між мінералами, використовуючи в якості змінних величину парціального тиску деяких газів. Для геолога в цьому сенсі найбільш важливі О2, СО2 і S2. Співвідношення між оксидами, карбонатами і сульфідами кожного металу можна представити у вигляді окремих діаграм, а для рівняння такі діаграми можна накладати один на одного. Подібне накладення допустимо при зіставленні положень полів стійкості мінералів кожної з діаграм і не може бути витлумачено як зображення стійких співвідношень всіх можливих стабільних фаз. Що ж стосується розібраних діаграм подібного типу, то необхідно вказати на три основні обмеження:
1) наявні дані поки недостатні і не дозволяють розглядати зміни в складі реальних мінералів; 2) для геологів було б вельми цікаво розглядати взаємодії (компонентів з різних систем), що призводять до утворення нових мінеральних видів; між тим просте накладення діаграм в цьому випадку не завжди може допомогти; 3) хоча по парціальним тискам газів зручно порівнювати стійкі співвідношення різних мінералів, все ж розрахункові величини тисків настільки малі (за винятком P CO2), що майже не мають фізичного сенсу. Попередньо обчислені значення парціальних тисків можна перевірити безпосередньо на експерименті і нелегко зіставити їх з конкретними, що спостерігаються в поле умовами.
вправо
6.1. Розрахуйте рівноважний парціальний тиск кисню для реакції SnОкріст + 1 / 2О2 газ = SnО2 крист при 25 ° С і загальному тиску 1 атм.
Відповідь: Р O2 = 10-90,5 атм.
6.2. Яка величина парціального тиску S2 газ в рівновазі з ромбічної сірої при 25 ° С і 1 атм загального тиску? Відповідь: P S2 = 10-14,0 атм.
6.3. Побудуйте діаграму, яка ілюструє стійкі співвідношення UО2 крист, UО3 крист і UО2СО3 у вигляді функції lg P O2 і lg P CO2.
Л І Т Е Р А Т У Р А
1. M c До instry Н. Е. Phase assemblages in sulfide ore deposits, NY Acad. Sci., Ser. II, 20, 15-26, 1957.
2. M c K instry Н. Е., K ennedy GC Some suggestions concerning the sequence of certain ore minerals, Econ. Geol., 52, 379-390, 1957.
3. N atarajan R. Неопубліковані дані. Department of Geology, Harvard University, 1958.
РЕКОМЕНДОВАНА ЛІТЕРАТУРА
D arken LS, G urr у RW The Physical Chemistry of Metals, New York, McGraw-Hill, 535 pp., 1953. (Є російський переклад: Д а р к е н Л. С., Г у р р і Р. В. Фізична хімія металів, М., Металлургиздат, 1960.)
S chmitt Н. Н. (е d.). Equilibrium Diagrams for Minerals, Cambridge, Mass., The Geological Club of Harvard, 1962.