прості ефіри
прості ефіри
- Зміст глави:
- Прості ефіри. Отримання простих ефірів. Властивості простих ефірів.
- Етиленоксид. Краун-ефіри.
Прості ефіри являють собою з'єднання, в яких два вуглеводневих радикала пов'язані атомом кисню. Систематична номенклатура розглядає прості ефіри як похідні алканів, наприклад діетиловий ефір слід називати етоксіетаном, анізол метоксібензолом. За раціональної номенклатурі назви простих ефірів складають по іменах з додаванням слова «ефір»: діетиловий ефір, метілетіловий ефір, дифеніловий ефір. Застосовується "оксидная" номенклатура: діфенілоксід = дифеніловий ефір, іноді використовуються тривіальні назви: діетиловий ефір = сірчаний ефір (за способом отримання) або просто ефір, анізол (метілфеніловий ефір), фенетол (етілфеніловий ефір).
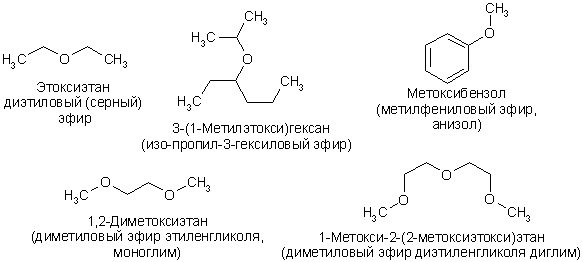
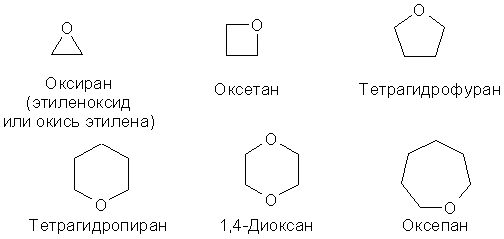
Для циклічних ефірів номенклатурою IUPAC зареєстровані тривіальні назви, наприклад:
Отримання простих ефірів
Прості ефіри утворюються з спиртів при дії кислот, що володіють водовіднімаючих властивостями, таких як H2SO4 або поліфосфорна кислота.
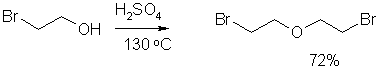
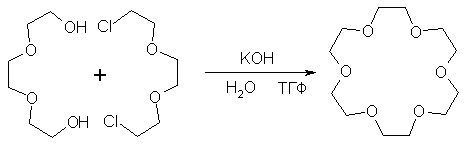
Реакція Вільямсона відкриває ширші можливості, тому що дозволяє синтезувати несиметричні ефіри.

Ця реакція стала інтенсивно використовуватися для синтезу відкритих в 60-і роки краун-ефірів.
Властивості простих ефірів
Хімічні властивості простих ефірів обумовлені присутністю атома кисню, пов'язаного з двома С-атомами. Дві несвязивающіх пари електронів кисню обумовлюють основність (по Льюїсу) простих ефірів. Нижчі представники порівняно непогано розчиняються у воді (водневі зв'язки), з сильними кислотами вони утворюють гідроксоніевие солі. Тому діетиловий ефір розчинний в концентрованій соляній кислоті і виділяється при розведенні розчину водою.

Кислоти Льюїса з простими ефірами дають солеобразние оксоніевие з'єднання, які називають ефіратамі. Кислота і підстава пов'язані донорно-акцепторної зв'язком.

Комплекси ефірів з трифторид бору досить стабільні і в синтетичних цілях, наприклад, зручним реагентом є ефірат трифторида бору: сам BF3 при кімнатній температурі являє собою газоподібна речовина, діетиловий ефір кипить при 34.5 ° С, тоді як їх комплекс переганяється без розкладання при 129 ° С.
Незважаючи на полярність зв'язку С-О в молекулах простих ефірів (m = 1,6D), вони не реагують з нуклеофилами. Ймовірно, це обумовлено тим, що в ході розщеплення мало б статися витіснення нуклеофілом більш сильного підстави - алкоголят-іона (погана йде група). Навпаки, в сильнокислой середовищі, де погана йде група алкоксид-іон перетворюється в гарну йде групу (молекулу спирту), прості ефіри розщеплюються дією сильних нуклеофілів. Так, ефіри розщеплюються до відповідного спирту і алкілгалогеніду під дією HBr або HI (але не HCl):
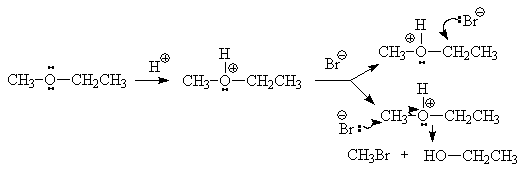

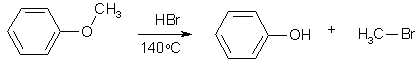
Прості ефіри легко вступають реакції вільно-радикального заміщення по α-вуглецевого атома. Так, отримання хлордіетілового ефіру ведуть дією хлору на ефір при -20 ° С.
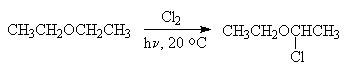
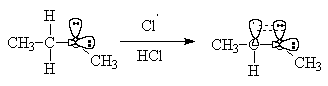
Настільки легке заміщення при α-С-атомі пояснюють тим, що в результаті відриву атома водню виникає радикальна частка, стабілізована за рахунок знаходження неспареного електрона в поле атома кисню ( "три електрона в поле двох атомів").
Ця ж обставина є причиною легкості окислення простих ефірів киснем повітря по вільно-радикальному механізму. Внаслідок цього пари ефірів утворюють з повітрям вибухову суміш, а під час зберігання ефіру в ньому накопичуються гідропероксид, які, завдяки більш високій температурі кипіння, залишаються в перегінній колбі і в кінці перегонки можуть вибухати. Тому ефіри перед перегонкою обробляють розчином солей двовалентного заліза або твердим лугом.
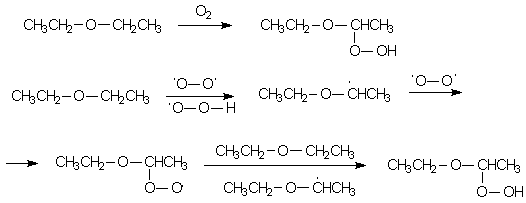
У той же час прості ефіри дуже стійкі до дії інших окислювачів, сильних кислот (крім HBr і HI) і підстав, в т.ч. металоорганічнихз'єднань, і тому широко використовуються в лабораторній практиці як розчинники, особливо це стосується діетилового ефіру, ТГФ, діоксану і Глім.
α-Хлорзамещенние ефіри вступають як дуже активні електрофіли в реакції нуклеофільного заміщення хлору по мономолекулярному механізму з різними реагентами ціанід-, йодид-, ацетат-іоном. Етілхлорметіловий ефір гідролізується в 1 · 109 разів швидше тре -бутілхлоріда за механізмом SN1, а метілхлорметіловий ефір лише в 400 разів швидше, ніж хлоретан, по SN2-механізмом. Перевагу SN1-механізму легко пояснюється резонансної стабілізацією карбокатіон.

Вправи до теми "Прості ефіри"