електропровідність електролітів
Електропровідність електролітів, здатність електролітів проводити електричний струм при додатку електричної напруги. Носіями струму є позитивно і негативно заряджені іони - катіони і аніони , Які існують в розчині внаслідок електролітич. дисоціації . Іонна електропровідність електролітів, на відміну від електронної, характерною для металів , Супроводжується перенесенням речовини до електродів з утворенням поблизу них нових хімічних сполук. Загальна (сумарна) провідність складається з провідності катіонів та аніонів, які під дією зовнішнього електричного поля рухаються в протилежних напрямках. Частка загального кол-ва електрики, що переноситься окремими іонами, називається числами переносу , Сума яких для всіх видів іонів, що беруть участь в перенесенні, дорівнює одиниці.
Кількісно електропровідність електролітів характеризують еквівалентної електропровідністю 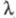 - проводить здатністю всіх іонів, що утворюються в 1 грам-еквіваленті електроліту. величина
- проводить здатністю всіх іонів, що утворюються в 1 грам-еквіваленті електроліту. величина 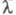 пов'язана з питомою електропровідністю
пов'язана з питомою електропровідністю 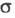 співвідношенням:
співвідношенням:
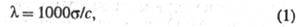
де с - концентрація розчину в г-екв / л. Еквівалентна електропровідність залежить від природи розчиненої речовини і розчинника, структурирозчину, а також від концентрації, температури, тиску. Гранично розбавленому розчину, в якому все молекули диссоційовані на іони, відповідає граничне значення 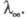 Відповідно до Кольрауша законом
Відповідно до Кольрауша законом 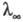 дорівнює сумі еквівалентних електропровідностей катіонів та аніонів. Еквівалентна електропровідність окремого іона пропорційна швидкості його руху в розчині і характеризує рухливість іона в розчині.
дорівнює сумі еквівалентних електропровідностей катіонів та аніонів. Еквівалентна електропровідність окремого іона пропорційна швидкості його руху в розчині і характеризує рухливість іона в розчині.
Опис концентраційної залежності 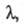 як і інших властивостей розчинів електролітів (Див. розчини електролітів ), Зазвичай базується на іонному підході, в рамках якого розчинник розглядається як бесструктурная діелектрична середовище, в якому іони рухаються відповідно до законів гідродинаміки і характером межіонного взаємодії. Найпростішою моделлю є модель заряджених твердих сфер, що рухаються в в'язкому розчиннику під впливом сили, зумовленої градієнтом потенціалу. При цьому сила опору руху іона в розчині визначається рівнянням Стокса. В рамках застосовності цього рівняння виконується правило Вальдена-Писаржевського, відповідно до якого для одного і того ж електроліту в будь-яких розчинниках твір граничного значення еквівалентної електропровідності
як і інших властивостей розчинів електролітів (Див. розчини електролітів ), Зазвичай базується на іонному підході, в рамках якого розчинник розглядається як бесструктурная діелектрична середовище, в якому іони рухаються відповідно до законів гідродинаміки і характером межіонного взаємодії. Найпростішою моделлю є модель заряджених твердих сфер, що рухаються в в'язкому розчиннику під впливом сили, зумовленої градієнтом потенціалу. При цьому сила опору руху іона в розчині визначається рівнянням Стокса. В рамках застосовності цього рівняння виконується правило Вальдена-Писаржевського, відповідно до якого для одного і того ж електроліту в будь-яких розчинниках твір граничного значення еквівалентної електропровідності 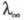 на в'язкість розчинника
на в'язкість розчинника 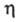 є постійною величиною, яка не залежить від природи розчинника, але є функцією температури. Порівняно добре це правило виконується тільки для слабо сольватованих іонів, зокрема іонів, що мають великі розміри в кристалічній фазі. Зі збільшенням концентрації значення
є постійною величиною, яка не залежить від природи розчинника, але є функцією температури. Порівняно добре це правило виконується тільки для слабо сольватованих іонів, зокрема іонів, що мають великі розміри в кристалічній фазі. Зі збільшенням концентрації значення 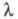 зменшується в основному в розчинах слабких електролітів і в області малих концентрацій задовільно описується законом розведення Оствальда.
зменшується в основному в розчинах слабких електролітів і в області малих концентрацій задовільно описується законом розведення Оствальда.
У розчинах сильних електролітів концентрац. залежність 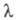 визначається межіонним взаємодією. В області застосовності теорії Дебая-Хюккеляімеются дві причини для гальмування іонів внаслідок межіонного взаємодії. Перша з них пов'язана з тим, що рух іона гальмується іонної атмосферою, яка має заряд, протилежний центральному йону, і під впливом поля рухається в напрямку, протилежному переміщенню іона (електрофоретичний ефект). Друга причина пов'язана з тим, що при русі іона під дією електричного поля його іонна атмосфера деформується і втрачає сферичну симетрію, причому більша частина заряду іонної атмосфери концентрується позаду центрального іона (релаксаційний ефект). Облік обох ефектів призводить до рівняння Онсагера:
визначається межіонним взаємодією. В області застосовності теорії Дебая-Хюккеляімеются дві причини для гальмування іонів внаслідок межіонного взаємодії. Перша з них пов'язана з тим, що рух іона гальмується іонної атмосферою, яка має заряд, протилежний центральному йону, і під впливом поля рухається в напрямку, протилежному переміщенню іона (електрофоретичний ефект). Друга причина пов'язана з тим, що при русі іона під дією електричного поля його іонна атмосфера деформується і втрачає сферичну симетрію, причому більша частина заряду іонної атмосфери концентрується позаду центрального іона (релаксаційний ефект). Облік обох ефектів призводить до рівняння Онсагера:
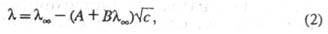
де А і В - емпіричні постійні, які є функціями температури, в'язкості і діелектричної проникності розчинника.
Як і теорія Дебая-Хюккеля, рівняння Онсагера обмежена областю помірно розбавлених розчинів. Для опису концентрованих розчинів виникає необхідність в обліку некулоновской частини межіонного взаємодії, зокрема в обліку іонних розмірів. Для цієї мети застосовують методи кінетичної теорії іонних систем. До додаткового зменшення 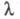 призводить освіту іонних асоціатів - пар, трійників і т. п., яке, як і ефект неповної дисоціації , Скорочує загальне число вільних іонів в розчині. Для обліку цього ефекту в рівнянні Онсагера замінюють загальну концентрацію іонів концентрацією вільних іонів
призводить освіту іонних асоціатів - пар, трійників і т. п., яке, як і ефект неповної дисоціації , Скорочує загальне число вільних іонів в розчині. Для обліку цього ефекту в рівнянні Онсагера замінюють загальну концентрацію іонів концентрацією вільних іонів 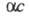 (
( 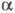 - ступінь електролітичної дисоціації , Що призводить до рівняння Фуосса-Онсагера:
- ступінь електролітичної дисоціації , Що призводить до рівняння Фуосса-Онсагера:
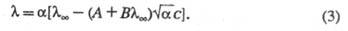
У змінних електричних полях при досить високій частоті іон не йде далеко від центру іонної атмосфери, внаслідок чого вона не деформується. Обумовлений деформацією релаксаційний ефект не виникає, що призводить до збільшення 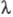 - так званий ефект Дебая-Фалькенхагена. величина
- так званий ефект Дебая-Фалькенхагена. величина 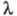 зростає також в постійних електричних полях досить високої напруженості (104-105 В / см). В цих умовах іони рухаються настільки швидко, що іонна атмосфера не встигає утворитися, внаслідок чого практично відсутні і релаксаційні і електрофоретичні ефекти. В результаті
зростає також в постійних електричних полях досить високої напруженості (104-105 В / см). В цих умовах іони рухаються настільки швидко, що іонна атмосфера не встигає утворитися, внаслідок чого практично відсутні і релаксаційні і електрофоретичні ефекти. В результаті 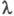 прагне до граничного значення
прагне до граничного значення 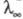 (Так званий ефект Віна). У слабких електролітах ефект Вина викликається також зміщенням диссоциативного рівноваги в сильному електричного поле в бік утворення іонів.
(Так званий ефект Віна). У слабких електролітах ефект Вина викликається також зміщенням диссоциативного рівноваги в сильному електричного поле в бік утворення іонів.
Вплив температури і тиску на електропровідність електролітів обумовлено зміною граничного значення 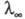 внаслідок зміни структури розчинника і характеру іон-молекулярної взаємодії, зміни впливу межіонного взаємодії і зміщення диссоциативного рівноваги. Більш детальний опис механізму електропровідності електролітів в широкій області концентрацій, температур і тисків можливо в рамках іон-молекулярного підходу. При цьому питома електропровідність розраховують через електричний потік j (t) =
внаслідок зміни структури розчинника і характеру іон-молекулярної взаємодії, зміни впливу межіонного взаємодії і зміщення диссоциативного рівноваги. Більш детальний опис механізму електропровідності електролітів в широкій області концентрацій, температур і тисків можливо в рамках іон-молекулярного підходу. При цьому питома електропровідність розраховують через електричний потік j (t) = 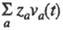 і автокорреляционную функцію
і автокорреляционную функцію 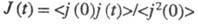 за допомогою співвідношення:
за допомогою співвідношення:

де 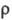 - к-ть іонів електроліту в одиниці об'єму розчину, е - елементарний електричний заряд,
- к-ть іонів електроліту в одиниці об'єму розчину, е - елементарний електричний заряд, 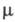 - наведена маса катіона і аніона, za - ступінь окислення іона сорту a, Vа (t) - його швидкість в момент часу t.
- наведена маса катіона і аніона, za - ступінь окислення іона сорту a, Vа (t) - його швидкість в момент часу t.
Специфічний механізм електропровідності характерний для кислот і підстав, що містять соотв. іони Н + і ОН-, які у водних розчинах (або інших протонних розчинниках) мають рухливість на порядок більше за інших іонів. Для пояснення аномально високої провідності іонів Н + і ОН-передбачається, що під впливом електричного поля протони переміщуються не тільки шляхом міграції, а й за механізмом протонного обміну, що включає перенесення протона в кислому середовищі від іонів гідроксонію Н3О + до молекули води, а в лужному - від молекули води до іона ОН-.
Експериментальне вивчення електропровідність електролітів - важливий напрямок фізико-хімічного аналізу, оскільки залежність електропровідності електролітів від складу розчину дозволяє судити про концентрацію солей, якісний, склад яких відомий (див. Також кондуктометрія ) Вимірювання l використовують для визначення подвижностей іонів.
Літ .: Ськорчеллетті В. В., Теоретична електрохімія, 4 видавництва., Л., 1974; Ізмайлов Н. А., Електрохімія розчинів, 3 вид., М., 1976; Ерделі-вантаж Т., Явища перенесення у водних розчинах, пров. з англ., М., 1976. Див. також літ. до ст. розчини електролітів
М. Ф. Головко.